Fælles europæiske vurderinger
Spørgsmål og svar om EU HTA
- Hvad er EU’s HTA-forordning?
- Hvad betyder EU-HTA-samarbejdet for Medicinrådet og virksomheder?
- Hvem udarbejder de fælles kliniske vurderinger?
- Hvilke lægemidler er omfattet af samarbejdet?
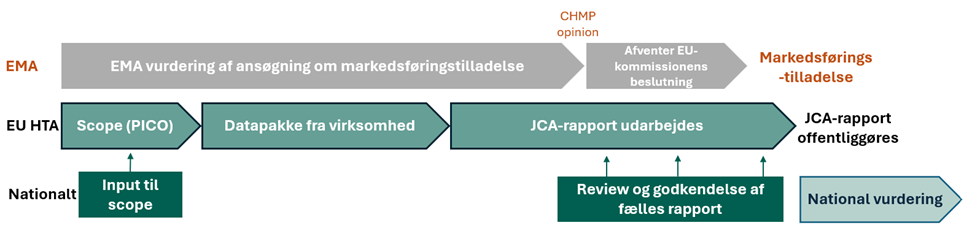
- Hvordan forløber en fælles klinisk vurdering?
- Hvordan forløber et fælles videnskabeligt samråd?
- Hvordan samarbejder de danske HTA-organisationer?
- Hvilke konkrete opgaver løser Medicinrådet i EU-samarbejdet?
- Hvor finder jeg mere information?
Europæisk samarbejde
Fælles EU-vurderinger af sundhedsteknologi
EU har etableret et fælles samarbejde om vurdering af sundhedsteknologier under HTA-forordningen. Det betyder, at Medicinrådet samarbejder med andre organisationer i EU om at vurdere dokumentationen for nye lægemidlers effekt og sikkerhed i forhold til de eksisterende behandlinger i EU-landene. På denne side kan du læse mere om samarbejdet og finde svar på ofte stillede spørgsmål. Arbejdet er beskrevet i EU’s forordning om sundhedsteknologivurdering (HTA).
Du kan se oversigten over igangværende fælles kliniske vurderinger på EU-kommisionens hjemmeside under 'List of ongoing joint clinical assessments' eller tilgå filen direkte her.